Contoh Soal dan Jawaban PAS Kimia Kelas 10 Semester 1
Contoh Soal dan Jawaban PAS Kimia-Yuk simak buat kalian siswa kelas 10, pada pertemuan kali ini kami akan memberikan Contoh Soal dan Jawaban PAS Kimia Kelas 10 Semester 1 (Kurikulum Merdeka). Dilansir dari modul buku IPA kurikulum merdeka oleh kemendikbud mata pelajaran kimia digabung menajdi satu buku yang dibagi dengan sistem blok.
Nah berdasarkan buku tersebut, materi kimia dikelas 10 terdapat pada bab 3 dan 4 untuk semester 1 dan bab 5 untuk semester 2. BAB 3 mempelajari tentang kimia hijau dalam pembangunan berkelanjutan 2022 Dan BAB 4 mempelajari hukum dasar kimia disekitar kita.
Berikut Contoh Soal dan Jawaban PAS Kimia Kelas 10 Semester 1
1. Kimia Hijau merupakan segala kegiatan kimia yang mengarah pada pelestarian lingkungan. Untuk itu berikut pentingnya kimia hijau kecuali …..
A. Membuat lingkungan rumah aman dan sehat
B. Membuat udara, air, tanah, tanaman, dan hewan terhindar paparan bahan kimia
C. Tidak ikut melindungi dan merusak ozon bumi
D. Menjaga lingkungan tetap asri dan sehat
E. Membuat bumi terhindar dari pemanasan global dan bencana alam
Jawaban: C. Tidak ikut melindungi dan merusak ozon bumi
Pembahasan:
Pentingnya kimia hijau
1. Pentingnya kimia hijau adalah membuat lingkungan rumah aman dan sehat
2. Pentingnya kimia hijau adalah membuat lingkungan sekitar rumah aman dan sehat.
3. Pentingnya kimia hijau adalah membuat udara, air, tanah, tanaman, dan hewan terhindar dari paparan bahan kimia berbahaya.
4. Pentingnya kimia hijau adalah menjaga lingkungan tetap asri dan sehat.
5. Pentingnya kimia hijau adalah membuat bumi terhindar dari pemanasan global dan bencana alam.
2. Partikel bermuatan positif yang terdapat dalam inti atom adalah . . . .
A. proton
B. inti atom
C. neutron
D. elektron
E. atom
Jawaban: B. inti atom
Pembahasan:
Percobaan Rutherford, hamburan sinar alfa oleh lempeng emas. Hasil percobaan ini membuat Rutherford menyatakan hipotesisnya bahwa atom tersusun dari inti atom yang bermuatan positif dan dikelilingi elektron yang bermuatan negatif, sehingga atom bersifat netral
3. Partikel dasar penyusun atom terdiri atas proton, neutron, dan elektron. Muatan listrik partikel dasar tersebut berturut-turut adalah ….
A. -1, +1, 0
B. +1, -1, 0
C. +1, 0, -1
D. -1, 0,+1
E. 0, -1, +1
Jawaban: C. +1, 0, -1
Pembahasan
Berdasarkan percobaan tetes Milikan ditemukan seperti tabel:
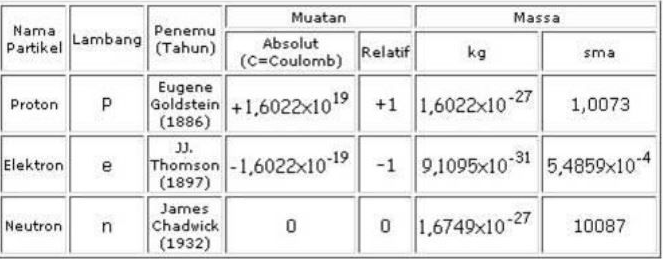
4. Pernyataan berikut yang tidak benar adalah ….
A. elektron ditemukan oleh J.J. Thomson
B. sinar terusan bermuatan positif
C. inti atom ditemukan oleh Niels Bohr
D. inti atom bermuatan positif
E. sinar katoda bermuatan negatif
Jawaban: C. inti atom ditemukan oleh Niels Bohr
Pembahasan:
Inti atom ditemukan oleh Rutherford bukan Niels Bohr
5. Kalium mempunyai nomor atom 19 dan nomor massa 39. Jumlah elektron pada ion
Kalium adalah ….
A. 21
B. 20
C. 19
D. 18
E. 17
Jawaban: C. 19
Pembahasan:
Jumlah elektron atom dalam keadaan netral sama dengan jumlah proton (nomor atom) dalam hal ini sama dengan 19
6. Partikel dasar dalam atom terdiri dari ….
A. Proton, elektron, dan positron
B. Proton, neutron, dan nukleon
C. Proton, elektron, dan neutron
D. Positron, nukleon, dan elektron
E. Neutron, nukleon, dan elektron
Jawaban: C. Proton, elektron, dan neutron
7. Kata kimia berasal dari “al kimiya” yang artinya ….
A. Pembentuk materi
B. Perubahan materi
C. Penghasil materi
D. Penyusun materi
E. Penanganan materi
Jawaban: B. Perubahan materi
Pembahasan: Kimia (dari bahasa Arab, kimiya = perubahan benda/zat atau bahasa Yunani khemeia).
8. Contoh molekul unsur adalah ….
A. CO2
B. H2O
C. CaCO3
D. O2
E. OH-
Jawaban: D. O2
Pembahasan: Molekul unsur adalah gabungan dua unsur atau lebih dengan jenis unsur yang sama, contoh: O2, N2, H2, dan P4.
Molekul senyawa adalah gabungan dua unsur atau lebih dengan jenis unsur yang berbeda, contoh: CO2, H2O, dan CaCO3.
Ion adalah Unsur yang mempunyai muatan positif atau negative, contoh: Na+, Cl-, dan Ca2+
9. Teori atom yang dapat menerangkan adanya spektrum atom hidrogen adalah teori
atom ….
A. Bohr
B. Rutherford
C. Thomson
D. Rydberg
E. Dalton
Jawaban: A. Bohr
10. Pokok teori atom Thomson dititikberatkan pada ….
A. Atom terdiri dari elektron – electron
B. Elektron sebagai penyusun utama atom
C. Atom sebagai bola masif yang hanya berisi elektron
D. Atom sebagai bola masif bermuatan positif yang di dalamnya tersebar elektron sehingga keseluruhannya bersifat netral
E. proton dan elektron adalah bagian penyusun atom yang keduanya saling meniadakan
Jawaban: D. Atom sebagai bola masif bermuatan positif yang di dalamnya tersebar elektron sehingga keseluruhannya bersifat netral
Pembahasan:
Teori Atom Thomson Atom adalah partikel positif dengan elektron-elektron yang tersebar di dalamnya Jika unsur-unsur disusun berdasarkan kenaikan nomor massa atom, sifat unsur tersebut akan berulang pada unsur kedelapan. Pernyataan ini dikenal dengan hukum oktaf yang dikemukakan oleh ….
A. Dobereiner
B. Newlands
C. Lothar Meyer
D. Mendeleev
E. Moseley
Jawaban: B. Newlands
Pembahasan:
Menurut Newlands, jika unsur-unsur diurutkan letaknya sesuai dengan kenaikan massa atom relatifnya, maka sifat unsur akan berulang pada setiap unsur kedelapan. Keteraturan ini sesuai dengan pengulangan not lagu (oktaf) sehingga disebut Hukum Oktaf (law of octaves).
12. Menurut hukum Triade, jika massa atom relatif kalsium 40 dan massa atom relatif
barium 137 maka massa atom relatif stronsium sebesar ….
A. 80,5
B. 85,5
C. 88,5
D. 90,5
E. 95,5
Jawaban: C. 88,5
Pembahasan:
Dobereiner juga menemukan bahwa massa atom unsur kedua adalah rata-rata massa atom unsur pertama dan unsur ketiga.
Jika diketahui suatu triade terdiri atas Ca – Sr – Ba dan massa atom Ca = 40, massa atom Ba = 137, maka:
Massa atom Sr = 𝑚𝑎𝑠𝑠𝑎 𝑎𝑡𝑜𝑚 𝐶𝑎+𝑚𝑎𝑠𝑠𝑎 𝑎𝑡𝑜𝑚 𝐵𝑎 /2 = 40+137/2 = 88,5
13. Letak unsur dan konfigurasi elektron yang tepat untuk unsur 19X adalah … (nomor atom Ar = 18)
A. Periode 4, golongan IA, [Ar] 4s1
B. Periode 1, golongan IB, [Ar] 4d1
C. Periode 1, golongan IIA, [Ar] 4s2
D. Periode 2, golongan IIB, [Ar] 4d2
E. Periode 3, golongan IVA, [Ar]4s2 3d2
Jawaban: E. Periode 3, golongan IVA, [Ar]4s2 3d2
Pembahasan:
18 Ar = 1s2 2s2 2p6 3s2 3p6 4s2
19 X = [ Ar ] 4s1 elektron valensi = 1 Kulit valensi 4
Maka unsur X terletak pada golongan IA , Periode 4
14. Lima unsur dalam satu periode dinyatakan sebagai berikut!
(1) Massa atom unsur B lebih kecil daripada unsur C.
(2) Keelektronegatifan unsur A lebih besar daripada unsur D tetapi lebih kecil daripada unsur B.
(3) Energi ionisasi unsur E lebih kecil daripada unsur D.
(4) Jumlah elektron valensi unsur A lebih kecil daripada unsur B.
Urutan letak unsur dalam tabel periodik unsur dari kiri ke kanan adalah ….
A. A, B, C, D, dan E
B. A, B, C, E, dan D
C. C, E, D, A, dan B
D. E, D, C, B, dan A
E. E, D, A, B, dan C
Jawaban: E. E, D, A, B, dan C
Pembahasan: (1) Massa atom unsur B lebih kecil daripada unsur C. = artinya letak unsur B disebelah kiri C
(2) Keelektronegatifan unsur A lebih besar daripada unsur D tetapi lebih kecil daripada unsur B.= artinya letak unsur A disebelah kanan
(3) Energi ionisasi unsur E lebih kecil daripada unsur D.= artinya letak unsur E disebelah kiri D
(4) (4) Jumlah elektron valensi unsur A lebih kecil daripada unsur B.= artinya letak unsur A disebelah kiri B Dari sini dapat disimpulkan urutan unsur – unsur tersebut adalah E D A B dan C
15. Kelompok unsur berikut yang semuanya bersifat logam yaitu ….
A. Emas, seng, dan Karbon
B. Besi, nikel dan belerang
C. Fosfor, oksigen dan tembaga
D. Emas, perak dan nikel
E. Belerang, fosfor dan perak
Jawaban: D. Emas, perak, dan nikel
Demikian beberapa Contoh Soal dan Jawaban PAS Kimia Kelas 10 Semester 1 yang bisa kalian manfaatkan sebagai bahan ajar di kurikulum merdeka in. Semoga Bermanfaat



